飛秒激光輔助構建微型器官模型中人工血管網絡的研究
一、生物醫學研究領域的技術革新
2025年6月3日,維也納工業大學(TUWien)與日本慶應義塾大學的研究團隊聯合宣布,成功開發出一種快速且可重復的微型器官模型人工血管構建方法。相關成果發表于生物制造領域權威期刊《Biofabrication》,該研究通過飛秒級超短激光脈沖在水凝膠材料中構建高精度三維結構,為器官芯片技術的工程化應用奠定了關鍵基礎。
在現代生物醫學研究中,器官芯片(Organs-on-a-Chip)技術正展現出不可替代的優勢。這種基于微流控芯片的組織培養系統,通過精確控制微環境參數,能夠實現比傳統動物實驗更高精度的生理過程模擬。然而,該技術長期面臨核心瓶頸:缺乏功能性血管網絡的微型器官無法完整復現人體組織的物質運輸與代謝功能,導致實驗結果與活體生理狀態存在顯著差異。構建可灌注的血管及毛細血管網絡,成為實現系統性研究并確保與生物體內數據可比的必要前提。
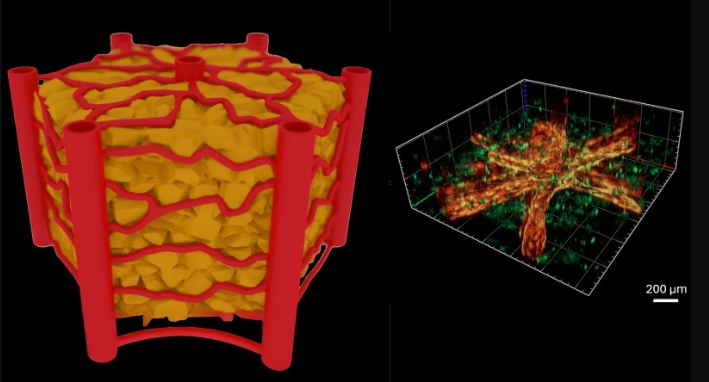
二、關鍵技術突破:高精度加工與材料優化
針對微脈管系統構建的可控性難題,研究團隊開發了基于飛秒激光直寫技術的三維血管成型方法。利用飛秒激光的超短脈沖特性(脈沖寬度達10?1?秒級),可在水凝膠材料中精確刻蝕出間距僅100微米的微通道,該密度參數與人體特定器官的天然血管分布高度吻合。相較于傳統自組裝方法導致的樣本間血管幾何形態顯著差異,該技術實現了結構參數的精準控制,為標準化生物醫學實驗提供了技術保障。
在解決結構精度問題的同時,研究團隊同步優化了材料制備工藝。通過創新的兩步熱固化技術,替代傳統單階段凝膠化過程:在不同溫度梯度下分階段處理水凝膠,促使其內部網絡結構重組,形成機械性能強化的三維支架。實驗數據表明,經該工藝處理的水凝膠在負載內皮細胞后,血管結構可長期保持開放狀態,有效抵御細胞主動重塑引發的形變或塌陷,為構建穩定的生物-機械耦合微環境提供了材料支撐。
三、生物功能性驗證與生理模擬效能
在肝臟類器官模型驗證中,該技術展現出卓越的生理模擬效能。通過構建貫穿整個組織體積的多層微脈管系統,實現了高效的營養物質與氧氣輸送,顯著提升了肝細胞的代謝活性。免疫熒光染色與功能檢測顯示,人工血管內壁的內皮細胞表現出與體內一致的生物學響應:在炎癥刺激下,細胞間隙連接發生重構,血管通透性呈現可控性升高,完全復現了天然血管的病理生理反應過程。
慶應義塾大學研究者MasafumiWatanabe指出,該技術成功解決了肝芯片研究中長期存在的微血管網絡構建難題。通過模擬肝臟復雜的微循環系統,新型血管化肝芯片能夠準確再現藥物代謝動力學過程,包括代謝產物生成路徑及毒性作用機制解析,其數據精準度已超越傳統動物模型的預測能力,為臨床前藥物發現提供了革命性工具。
四、工程化應用前景與產業轉化路徑
該技術的核心優勢在于高度可擴展性與工業級生產適配性。基于標準化的激光加工流程,單個微流控芯片可集成數十個獨立的血管化器官模塊,支持高通量藥物篩選與毒理學評估。當前,研究團隊已與法國Lumibird公司達成技術合作,致力于將核心工藝整合至商用微加工設備,預計2026年實現標準化生產系統的產業化落地。
在更廣闊的應用維度,該技術正推動器官芯片研究向多學科交叉領域延伸。例如,在航天醫學研究中,類似技術已用于構建微重力環境下的血管重構模型,成功揭示失重狀態對血管內皮細胞功能的影響機制,并篩選出具有防護作用的新型化合物。這種跨領域技術遷移,彰顯了人工血管構建技術在基礎研究與工程應用中的普適價值。
五、技術挑戰與未來研究方向
盡管取得階段性突破,該技術體系仍面臨生物相容性優化與制造成本控制等挑戰。水凝膠材料的長期植入免疫原性、激光加工過程中的熱損傷效應,以及高端精密設備的國產化需求,構成了后續研究的重點方向。值得關注的是,近期中科院團隊在納米級水凝膠材料改性領域的進展,為解決上述問題提供了新思路。通過結合鹽模板法、光交聯梯度固化等新技術,未來有望進一步提升血管網絡的生物力學性能與功能耐久性。
隨著全球監管機構對器官芯片技術的認證體系逐步完善(如美國FDA的“芯片上的人體”計劃),該研究成果標志著器官芯片技術邁向工業級應用的重要里程碑。通過工程學與生物學的深度交叉融合,新型血管化器官模型不僅為藥物研發提供了高效工具,更推動著精準醫學、再生醫學等領域的基礎研究范式變革。正如維也納工業大學AliceSalvadori博士所言:“當芯片上的微型器官能夠真實模擬人體生理功能,我們便擁有了打開生命科學黑箱的鑰匙。”
咨詢熱線(Tel): 0591-83855102
E-mail:uki@measopt.com
聯系人:翁女士(UKI)
地址:福建省福州市倉山區建新鎮西三環智能產業園A3棟
